- ALCYNES
- ALCYNESLes alcynes, encore appelés carbures acétyléniques, sont des hydrocarbures, pour la plupart aliphatiques (acycliques), dont la chaîne renferme deux carbones adjacents bicoordinés, hybrides sp. Leur formule développée fait apparaître une triple liaison entre les symboles de ces deux atomes de carbone qui échangent ainsi trois doublets d’électrons: c’est la liaison acétylénique. Cette dernière représente une importante insaturation qui caractérise la réactivité de la molécule. Par suite de leurs propriétés chimiques particulières, on distingue les alcynes vrais, dérivant de l’acétylène par une monosubstitution
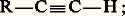 des alcynes substitués qui en dérivent par une double substitution
des alcynes substitués qui en dérivent par une double substitution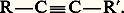 La formule générale des alcynes aliphatiques est Cn H2n-2 . Aucun n’existe à l’état naturel. Seul le premier terme, l’acétylène, a été décelé parfois dans l’air à l’état de traces: il se forme en effet lors de nombreuses combustions incomplètes. C’est le plus anciennement connu des alcynes. Il fut d’abord caractérisé dans le gaz d’éclairage grâce à sa combinaison cuivreuse dont on le régénérait, plus ou moins pur, par action de l’acide chlorhydrique. La réaction de la potasse alcoolique sur le bromure d’éthylène a constitué une synthèse partielle; Marcelin Berthelot réalisa, en 1855, sa synthèse totale, dans l’«œuf électrique», appareil dans lequel l’arc électrique jaillissait entre des électrodes de carbone dans une atmosphère d’hydrogène.Toutefois, l’accès pratique à l’acétylène ne vint que plus tard avec Henri Moissan. Son intérêt industriel, bien qu’en régression, demeure considérable. Les autres alcynes restent des produits de laboratoire, intéressants par eux-mêmes, et sont les agents d’assez nombreuses synthèses.1. Structure électronique de la liaison acétyléniqueLa liaison acétylénique résulte du recouvrement longitudinal des orbitales hybrides sp des deux atomes de carbone, formant une orbitale moléculaire liante de symétrie 靖, et du recouvrement latéral des deux couples d’orbitales py et pz formant deux orbitales moléculaires liantes de symétrie 神y et 神z . Cet ensemble de trois orbitales moléculaires ( 靖, 神y , 神z ) présente une symétrie cylindrique, de résolution autour de l’axe nucléaire qui est l’axe de symétrie de la molécule dans le cas de l’acétylène (fig. 1). L’alignement des noyaux des deux carbones acétyléniques et des deux atomes qui leur sont respectivement liés est une propriété structurale caractéristique de l’enchaînement acétylénique. Elle est responsable de l’absence d’isomérie géométrique (cis -trans ).Les distances internucléaires de la molécule d’acétylène sont significativement plus courtes que celles de l’éthane et de l’éthylène (tabl. 1). L’électronégativité du carbone sp étant supérieure à celles de l’hydrogène et du carbone sp3, la polarisation des liaisons des alcynes, autour de la triple liaison, est indiquée dans le tableau 1.2. NomenclatureLa nomenclature officielle provient de celle des alcènes par remplacement du suffixe -ène par -yne , la chaîne principale étant la plus longue de celles qui contiennent la triple liaison et dont le numérotage est conforme à la règle du plus petit nombre. Le nom des radicaux monovalents dérivant des alcynes est formé au moyen du suffixe -ynyle . Une nomenclature courante désigne l’éthyne comme l’acétylène et fait dériver le nom des alcynes et des alcynyles de celui du premier terme mono- ou disubstitué (tabl. 2). L’avantage de cette appellation est de faire apparaître le degré de substitution de la triple liaison: acétylène monosubstitué ou acétylénique vrai , qui possède un hydrogène lié au carbone acétylénique et acétylène disubstitué ou acétylénique substitué , qui ne possède pas un tel hydrogène.3. Préparations et modes de formationL’acétylène est préparé industriellement soit par hydrolyse du carbure de calcium, préparé lui-même par réaction au four électrique à 2 200 0C du coke et de l’oxyde de calcium, soit par pyrolyse à 1 400 0C du méthane ou encore par combustion incomplète avec l’oxygène à 1 500 0C [cf. ACÉTYLÈNE].Les alcynes sont obtenus par deux voies complémentaires, l’une correspond à une double élimination qui crée la triple liaison, l’autre à une alkylation simple ou double de l’acétylène qui conduit aux acétyléniques vrais et aux substitués.DéshydrohalogénationDérivés dihalogénés vicinauxCes dérivés sont facilement obtenus par addition d’un halogène Cl2 ou Br2 à un alcène. Sous l’action de la potasse alcoolique, à température modérée, une première déshydrohalogénation a lieu, conduisant à un halogénure vinylique. La seconde est beaucoup plus difficile [cf. HALOGÈNES] et nécessite des conditions plus sévères (120-200 0C); elle est fréquemment accompagnée d’isomérisations résultant de migrations de la triple liaison:
La formule générale des alcynes aliphatiques est Cn H2n-2 . Aucun n’existe à l’état naturel. Seul le premier terme, l’acétylène, a été décelé parfois dans l’air à l’état de traces: il se forme en effet lors de nombreuses combustions incomplètes. C’est le plus anciennement connu des alcynes. Il fut d’abord caractérisé dans le gaz d’éclairage grâce à sa combinaison cuivreuse dont on le régénérait, plus ou moins pur, par action de l’acide chlorhydrique. La réaction de la potasse alcoolique sur le bromure d’éthylène a constitué une synthèse partielle; Marcelin Berthelot réalisa, en 1855, sa synthèse totale, dans l’«œuf électrique», appareil dans lequel l’arc électrique jaillissait entre des électrodes de carbone dans une atmosphère d’hydrogène.Toutefois, l’accès pratique à l’acétylène ne vint que plus tard avec Henri Moissan. Son intérêt industriel, bien qu’en régression, demeure considérable. Les autres alcynes restent des produits de laboratoire, intéressants par eux-mêmes, et sont les agents d’assez nombreuses synthèses.1. Structure électronique de la liaison acétyléniqueLa liaison acétylénique résulte du recouvrement longitudinal des orbitales hybrides sp des deux atomes de carbone, formant une orbitale moléculaire liante de symétrie 靖, et du recouvrement latéral des deux couples d’orbitales py et pz formant deux orbitales moléculaires liantes de symétrie 神y et 神z . Cet ensemble de trois orbitales moléculaires ( 靖, 神y , 神z ) présente une symétrie cylindrique, de résolution autour de l’axe nucléaire qui est l’axe de symétrie de la molécule dans le cas de l’acétylène (fig. 1). L’alignement des noyaux des deux carbones acétyléniques et des deux atomes qui leur sont respectivement liés est une propriété structurale caractéristique de l’enchaînement acétylénique. Elle est responsable de l’absence d’isomérie géométrique (cis -trans ).Les distances internucléaires de la molécule d’acétylène sont significativement plus courtes que celles de l’éthane et de l’éthylène (tabl. 1). L’électronégativité du carbone sp étant supérieure à celles de l’hydrogène et du carbone sp3, la polarisation des liaisons des alcynes, autour de la triple liaison, est indiquée dans le tableau 1.2. NomenclatureLa nomenclature officielle provient de celle des alcènes par remplacement du suffixe -ène par -yne , la chaîne principale étant la plus longue de celles qui contiennent la triple liaison et dont le numérotage est conforme à la règle du plus petit nombre. Le nom des radicaux monovalents dérivant des alcynes est formé au moyen du suffixe -ynyle . Une nomenclature courante désigne l’éthyne comme l’acétylène et fait dériver le nom des alcynes et des alcynyles de celui du premier terme mono- ou disubstitué (tabl. 2). L’avantage de cette appellation est de faire apparaître le degré de substitution de la triple liaison: acétylène monosubstitué ou acétylénique vrai , qui possède un hydrogène lié au carbone acétylénique et acétylène disubstitué ou acétylénique substitué , qui ne possède pas un tel hydrogène.3. Préparations et modes de formationL’acétylène est préparé industriellement soit par hydrolyse du carbure de calcium, préparé lui-même par réaction au four électrique à 2 200 0C du coke et de l’oxyde de calcium, soit par pyrolyse à 1 400 0C du méthane ou encore par combustion incomplète avec l’oxygène à 1 500 0C [cf. ACÉTYLÈNE].Les alcynes sont obtenus par deux voies complémentaires, l’une correspond à une double élimination qui crée la triple liaison, l’autre à une alkylation simple ou double de l’acétylène qui conduit aux acétyléniques vrais et aux substitués.DéshydrohalogénationDérivés dihalogénés vicinauxCes dérivés sont facilement obtenus par addition d’un halogène Cl2 ou Br2 à un alcène. Sous l’action de la potasse alcoolique, à température modérée, une première déshydrohalogénation a lieu, conduisant à un halogénure vinylique. La seconde est beaucoup plus difficile [cf. HALOGÈNES] et nécessite des conditions plus sévères (120-200 0C); elle est fréquemment accompagnée d’isomérisations résultant de migrations de la triple liaison: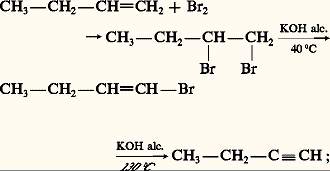
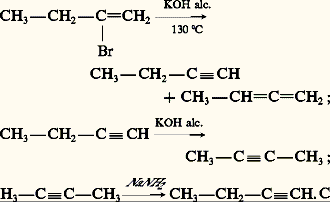 Alors que la base KOH alcoolique provoque normalement l’isomérisation de l’alcyne avec déplacement de la liaison acétylénique vers le centre de la chaîne, la base NaNH2, opérant en milieu anhydre, favorise au contraire le réarrangement de l’alcyne disubstitué en alcyne vrai. Il en résulte que l’amidure de sodium est préférable pour préparer un alcyne vrai et la potasse alcoolique pour préparer un alcyne substitué.Dérivés dihalogénés géminésCes dérivés sont facilement obtenus par halogénation des dérivés carbonylés, au moyen d’halogénures des acides phosphoreux et phosphorique. Leur déshydrohalogénation est réalisée dans les mêmes conditions que pour les dérivés vicinaux:
Alors que la base KOH alcoolique provoque normalement l’isomérisation de l’alcyne avec déplacement de la liaison acétylénique vers le centre de la chaîne, la base NaNH2, opérant en milieu anhydre, favorise au contraire le réarrangement de l’alcyne disubstitué en alcyne vrai. Il en résulte que l’amidure de sodium est préférable pour préparer un alcyne vrai et la potasse alcoolique pour préparer un alcyne substitué.Dérivés dihalogénés géminésCes dérivés sont facilement obtenus par halogénation des dérivés carbonylés, au moyen d’halogénures des acides phosphoreux et phosphorique. Leur déshydrohalogénation est réalisée dans les mêmes conditions que pour les dérivés vicinaux: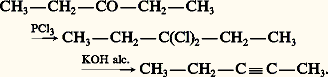 Ces méthodes de déshydrohalogénation étant complexes, elles sont actuellement réservées à la préparation du propyne ainsi que du phénylacétylène C6H5 漣CH 略CH2 à partir du styrène C6H5 漣C 令CH, aucune isomérisation n’étant à craindre.Méthodes synthétiquesLe point de départ est l’acétylène: on fait barboter le gaz pur et sec dans la solution bleue résultant de la dissolution du sodium ou du lithium dans l’ammoniac liquide:
Ces méthodes de déshydrohalogénation étant complexes, elles sont actuellement réservées à la préparation du propyne ainsi que du phénylacétylène C6H5 漣CH 略CH2 à partir du styrène C6H5 漣C 令CH, aucune isomérisation n’étant à craindre.Méthodes synthétiquesLe point de départ est l’acétylène: on fait barboter le gaz pur et sec dans la solution bleue résultant de la dissolution du sodium ou du lithium dans l’ammoniac liquide: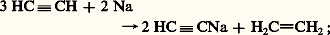 en effet, l’hydrogène libéré par la métallation se fixe, en partie du moins, sur l’acétylène. À l’acétylène monosodé on oppose un bromure, un sulfate ou un sulfonate d’alkyle:
en effet, l’hydrogène libéré par la métallation se fixe, en partie du moins, sur l’acétylène. À l’acétylène monosodé on oppose un bromure, un sulfate ou un sulfonate d’alkyle: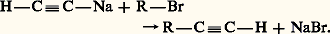 L’acétylénique vrai R 漣C 令C 漣H est sodé à l’amidure de sodium:
L’acétylénique vrai R 漣C 令C 漣H est sodé à l’amidure de sodium: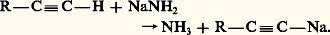 La seconde alkylation se produit dans les mêmes conditions que la première:
La seconde alkylation se produit dans les mêmes conditions que la première: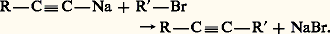 Cette méthode synthétique donne accès à tous les acétyléniques dans lesquels les substituants R et R sont primaires ou, à la rigueur, secondaires; dans le cas contraire, elle est plus ou moins concurrencée par une élimination sous l’action de la base mise en œuvre:
Cette méthode synthétique donne accès à tous les acétyléniques dans lesquels les substituants R et R sont primaires ou, à la rigueur, secondaires; dans le cas contraire, elle est plus ou moins concurrencée par une élimination sous l’action de la base mise en œuvre: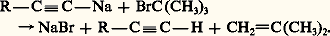 Les organomagnésiens acétyléniques peuvent remplacer les organoalcalins dans ces synthèses. On les prépare facilement par échange hydrogène-métal entre un alcyne vrai et le bromure d’éthylmagnésium.4. Propriétés physiquesLes températures d’ébullition des alcynes sont plus élevées que celles des alcanes correspondants; l’écart est de l’ordre de 6 0C pour les acétyléniques vrais, de 15 à 20 0C pour les acétyléniques substitués. Les termes symétriques cristallisent parfois; les autres très difficilement.Les alcynes sont miscibles aux hydrocarbures et aux solvants organiques usuels, un peu plus solubles dans l’eau que les alcènes et les diènes; cette propriété particulière est liée au caractère acide des alcynes vrais qui, par liaison hydrogène, peuvent s’associer aux solvants basiques tels que l’eau, les éthers et l’acétone: l’acétylène est conditionné, en tubes métalliques, en solution dans l’acétone.La formation de l’acétylène à partir de ses éléments (graphite et H2) est particulièrement endothermique:
Les organomagnésiens acétyléniques peuvent remplacer les organoalcalins dans ces synthèses. On les prépare facilement par échange hydrogène-métal entre un alcyne vrai et le bromure d’éthylmagnésium.4. Propriétés physiquesLes températures d’ébullition des alcynes sont plus élevées que celles des alcanes correspondants; l’écart est de l’ordre de 6 0C pour les acétyléniques vrais, de 15 à 20 0C pour les acétyléniques substitués. Les termes symétriques cristallisent parfois; les autres très difficilement.Les alcynes sont miscibles aux hydrocarbures et aux solvants organiques usuels, un peu plus solubles dans l’eau que les alcènes et les diènes; cette propriété particulière est liée au caractère acide des alcynes vrais qui, par liaison hydrogène, peuvent s’associer aux solvants basiques tels que l’eau, les éthers et l’acétone: l’acétylène est conditionné, en tubes métalliques, en solution dans l’acétone.La formation de l’acétylène à partir de ses éléments (graphite et H2) est particulièrement endothermique: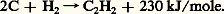 Pour cette raison, il est instable thermodynamiquement et tend à se décomposer de façon parfois violente, surtout s’il est comprimé ou liquéfié.Le spectre infrarouge d’un acétylénique vrai fournit une première bande importante vers 3 300 cm-1, caractéristique de la vibration d’élongation Csp 漣H; une seconde, assez faible, vers 2 100 cm-1, liée à la vibration d’élongation C 令C. Cette dernière n’entraînant pas de variation importante du moment dipolaire est de faible intensité; par contre, en spectrométrie de diffusion Raman, elle présente une intensité suffisante pour la caractérisation.La résonance magnétique nucléaire du proton des alcynes vrais se produit dans la même zone de déplacements chimiques que celle des alcanes, c’est-à-dire pour un champ magnétique relativement élevé. Le déplacement chimique du proton de l’acétylène est à 2,35 p.p.m., alors que celui des protons éthyléniques vinyliques est situé entre 4,8 et 6,2 p.p.m. Cette situation peut paraître anormale si l’on ne tient compte que de la plus grande polarisation de la liaison Csp 漣H (tabl. 1). En réalité, le facteur déterminant de ce haut champ de résonance est, comme dans le cas des protons vinyliques, l’importante polarisabilité du système électronique 神 qui se manifeste, dans le champ magnétique, par une circulation électronique génératrice d’un champ local induit. La polarisabilité maximale du système 神 éthylénique étant perpendiculaire au plan du squelette, le champ induit, au niveau des protons, s’ajoute au champ appliqué. Dans le cas de l’acétylène, la symétrie cylindrique du système 神 lui confère une polarisabilité maximale le long de l’axe nucléaire et le champ induit se retranche du champ appliqué. Le champ local auquel est soumis le proton vinylique est donc supérieur à celui appliqué, alors que, dans le cas de l’acétylène, il lui est inférieur (fig. 2).5. Propriétés chimiquesLa réactivité des alcynes est caractérisée par l’importante insaturation du système acétylénique qui se traduit par des additions électrophiles, nucléophiles et radicalaires. Les alcynes vrais présentent une réactivité particulière du groupe Csp 漣H dont l’acidité est supérieure à celle de l’ammoniac.AdditionsHydrogénationL’hydrogénation des alcynes est facile et met en jeu les mêmes catalyseurs que pour les alcènes: le platine (Pt), le palladium (Pd) et le nickel (Ni). Sans précautions particulières, ce sont deux molécules d’hydrogène qui s’ajoutent en formant l’alcane. Cependant, la réaction de la première molécule d’hydrogène, conduisant à l’alcène, est plus exothermique que l’addition de la seconde sur ce dernier, de sorte qu’il est possible de réaliser l’hydrogénation partielle de l’alcyne en alcène en mettant en œuvre un catalyseur peu actif. Le palladium désactivé par des sels de métaux lourds et la quinoléine ou le fer de Raney permettent cette hydrogénation partielle qui conduit à peu près exclusivement à l’alcène cis (réaction 1a).L’hydrogénation par voie chimique peut être réalisée par le sodium ou le lithium dans l’ammoniac liquide ou par l’hydrure de lithium et d’aluminium. Les alcènes étant insensibles à ces réactifs, cette méthode est sélective: elle conduit à l’alcène trans (réaction 1b).HalogénationLe chlore, le brome et l’iode se fixent sur les alcynes en donnant le dihalogénoéthylénique trans . La réaction est toutefois plus lente qu’avec les alcènes, comme le montre l’addition du brome sur le penten-4 yne-1:
Pour cette raison, il est instable thermodynamiquement et tend à se décomposer de façon parfois violente, surtout s’il est comprimé ou liquéfié.Le spectre infrarouge d’un acétylénique vrai fournit une première bande importante vers 3 300 cm-1, caractéristique de la vibration d’élongation Csp 漣H; une seconde, assez faible, vers 2 100 cm-1, liée à la vibration d’élongation C 令C. Cette dernière n’entraînant pas de variation importante du moment dipolaire est de faible intensité; par contre, en spectrométrie de diffusion Raman, elle présente une intensité suffisante pour la caractérisation.La résonance magnétique nucléaire du proton des alcynes vrais se produit dans la même zone de déplacements chimiques que celle des alcanes, c’est-à-dire pour un champ magnétique relativement élevé. Le déplacement chimique du proton de l’acétylène est à 2,35 p.p.m., alors que celui des protons éthyléniques vinyliques est situé entre 4,8 et 6,2 p.p.m. Cette situation peut paraître anormale si l’on ne tient compte que de la plus grande polarisation de la liaison Csp 漣H (tabl. 1). En réalité, le facteur déterminant de ce haut champ de résonance est, comme dans le cas des protons vinyliques, l’importante polarisabilité du système électronique 神 qui se manifeste, dans le champ magnétique, par une circulation électronique génératrice d’un champ local induit. La polarisabilité maximale du système 神 éthylénique étant perpendiculaire au plan du squelette, le champ induit, au niveau des protons, s’ajoute au champ appliqué. Dans le cas de l’acétylène, la symétrie cylindrique du système 神 lui confère une polarisabilité maximale le long de l’axe nucléaire et le champ induit se retranche du champ appliqué. Le champ local auquel est soumis le proton vinylique est donc supérieur à celui appliqué, alors que, dans le cas de l’acétylène, il lui est inférieur (fig. 2).5. Propriétés chimiquesLa réactivité des alcynes est caractérisée par l’importante insaturation du système acétylénique qui se traduit par des additions électrophiles, nucléophiles et radicalaires. Les alcynes vrais présentent une réactivité particulière du groupe Csp 漣H dont l’acidité est supérieure à celle de l’ammoniac.AdditionsHydrogénationL’hydrogénation des alcynes est facile et met en jeu les mêmes catalyseurs que pour les alcènes: le platine (Pt), le palladium (Pd) et le nickel (Ni). Sans précautions particulières, ce sont deux molécules d’hydrogène qui s’ajoutent en formant l’alcane. Cependant, la réaction de la première molécule d’hydrogène, conduisant à l’alcène, est plus exothermique que l’addition de la seconde sur ce dernier, de sorte qu’il est possible de réaliser l’hydrogénation partielle de l’alcyne en alcène en mettant en œuvre un catalyseur peu actif. Le palladium désactivé par des sels de métaux lourds et la quinoléine ou le fer de Raney permettent cette hydrogénation partielle qui conduit à peu près exclusivement à l’alcène cis (réaction 1a).L’hydrogénation par voie chimique peut être réalisée par le sodium ou le lithium dans l’ammoniac liquide ou par l’hydrure de lithium et d’aluminium. Les alcènes étant insensibles à ces réactifs, cette méthode est sélective: elle conduit à l’alcène trans (réaction 1b).HalogénationLe chlore, le brome et l’iode se fixent sur les alcynes en donnant le dihalogénoéthylénique trans . La réaction est toutefois plus lente qu’avec les alcènes, comme le montre l’addition du brome sur le penten-4 yne-1: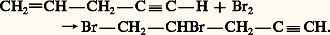 L’ajout d’une seconde molécule d’halogène peut se poursuivre dans le cas du chlore et, plus difficilement, du brome. L’addition du chlore sur l’acétylène conduit au tétrachloréthane symétrique. Ce solvant chloré, toxique et hydrolysable, est déshydrochloré par l’hydroxyde de calcium pour donner le trichloroéthylène, solvant industriel peu toxique et stable (réaction 2).HydrohalogénationEn l’absence de lumière et d’initiateurs radicalaires, les alcynes additionnent les acides chlorhydrique, bromhydrique et iodhydrique en formant un halogénure éthylénique qui peut, à son tour, se fixer à une seconde molécule d’hydracide. L’orientation de cette seconde addition est conforme à la règle de Markovnikov, et il se forme le dérivé gem-dihalogéné:
L’ajout d’une seconde molécule d’halogène peut se poursuivre dans le cas du chlore et, plus difficilement, du brome. L’addition du chlore sur l’acétylène conduit au tétrachloréthane symétrique. Ce solvant chloré, toxique et hydrolysable, est déshydrochloré par l’hydroxyde de calcium pour donner le trichloroéthylène, solvant industriel peu toxique et stable (réaction 2).HydrohalogénationEn l’absence de lumière et d’initiateurs radicalaires, les alcynes additionnent les acides chlorhydrique, bromhydrique et iodhydrique en formant un halogénure éthylénique qui peut, à son tour, se fixer à une seconde molécule d’hydracide. L’orientation de cette seconde addition est conforme à la règle de Markovnikov, et il se forme le dérivé gem-dihalogéné: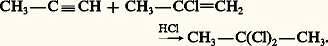 L’acétylène avec une molécule d’acide chlorhydrique conduit au chlorure de vinyle monomère, dont ce fut la première préparation industrielle (réaction 3).L’acide fluorhydrique anhydre s’ajoute à l’acétylène pour donner le fluorure de vinyle puis le 1,1-difluoroéthane (réaction 4).L’addition d’acide hypochloreux est facile, elle conduit aux dérivés carbonylés 見-halogénés; employé en excès, ce réactif donne les cétones 見, 見-dichlorées (réaction 5).En présence de lumière et à basse température, la réaction de l’acide bromhydrique sur les alcynes suit un cours très différent: elle est radicalaire en chaîne, et le produit majoritaire résulte d’une addition cis , anti-Markovnikov (réactions 6); le radical organobromé intermédiaire est probablement attaqué par la molécule HBr sur sa face la moins encombrée.HydratationEn présence d’un acide fort et d’un sel mercurique catalyseur, les alcynes sont hydratés en énols qui se transforment en cétones (réaction 7). Dans le cas de l’acétylène, on obtient l’acétaldéhyde, dont ce fut un procédé industriel de fabrication.HydroborationSelon un processus analogue à celui rencontré dans l’hydroboration des alcènes, le diborane B2H6 réagit avec les alcynes à 0 0C en formant un trivinylborane qui, comme dans le cas des alcènes, peut être hydrolysé en milieu acétique pour former un alcène, ou oxydé par l’eau oxygénée en alcool vinylique qui s’isomérise en dérivé carbonylé (réaction 8).HydroalcoxylationL’addition des alcools primaires aux alcynes a lieu en présence d’un catalyseur basique tel que l’alcoolate: le mécanisme est celui d’une addition nucléophile de l’alcoolate, suivie d’une protonation par l’alcool qui régénère le catalyseur alcoolate:
L’acétylène avec une molécule d’acide chlorhydrique conduit au chlorure de vinyle monomère, dont ce fut la première préparation industrielle (réaction 3).L’acide fluorhydrique anhydre s’ajoute à l’acétylène pour donner le fluorure de vinyle puis le 1,1-difluoroéthane (réaction 4).L’addition d’acide hypochloreux est facile, elle conduit aux dérivés carbonylés 見-halogénés; employé en excès, ce réactif donne les cétones 見, 見-dichlorées (réaction 5).En présence de lumière et à basse température, la réaction de l’acide bromhydrique sur les alcynes suit un cours très différent: elle est radicalaire en chaîne, et le produit majoritaire résulte d’une addition cis , anti-Markovnikov (réactions 6); le radical organobromé intermédiaire est probablement attaqué par la molécule HBr sur sa face la moins encombrée.HydratationEn présence d’un acide fort et d’un sel mercurique catalyseur, les alcynes sont hydratés en énols qui se transforment en cétones (réaction 7). Dans le cas de l’acétylène, on obtient l’acétaldéhyde, dont ce fut un procédé industriel de fabrication.HydroborationSelon un processus analogue à celui rencontré dans l’hydroboration des alcènes, le diborane B2H6 réagit avec les alcynes à 0 0C en formant un trivinylborane qui, comme dans le cas des alcènes, peut être hydrolysé en milieu acétique pour former un alcène, ou oxydé par l’eau oxygénée en alcool vinylique qui s’isomérise en dérivé carbonylé (réaction 8).HydroalcoxylationL’addition des alcools primaires aux alcynes a lieu en présence d’un catalyseur basique tel que l’alcoolate: le mécanisme est celui d’une addition nucléophile de l’alcoolate, suivie d’une protonation par l’alcool qui régénère le catalyseur alcoolate: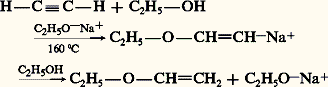 On obtient un éther d’alkyle et de vinyle. Catalysée par le trifluorure de bore, l’addition des alcools conduit à un acétal:
On obtient un éther d’alkyle et de vinyle. Catalysée par le trifluorure de bore, l’addition des alcools conduit à un acétal: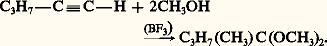 HydrocyanationDe même, l’addition de l’acide cyanhydrique à un alcyne conduit à un nitrile acrylique:
HydrocyanationDe même, l’addition de l’acide cyanhydrique à un alcyne conduit à un nitrile acrylique: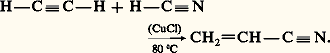 HydrocarboxylationLes acides carboxyliques peuvent se fixer sur les alcynes, en présence de catalyseurs tels que Hg++ ou Zn++, pour former des esters vinyliques. C’est ainsi qu’est fabriqué l’acétate de vinyle monomère à partir d’acétylène et d’acide acétique:
HydrocarboxylationLes acides carboxyliques peuvent se fixer sur les alcynes, en présence de catalyseurs tels que Hg++ ou Zn++, pour former des esters vinyliques. C’est ainsi qu’est fabriqué l’acétate de vinyle monomère à partir d’acétylène et d’acide acétique: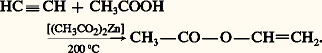 CarbonylationLes alcynes vrais réagissent avec le monoxyde de carbone en présence d’eau ou d’alcool et d’un catalyseur comme Ni(CO)4 en formant un acide 見-éthylénique ou son ester:
CarbonylationLes alcynes vrais réagissent avec le monoxyde de carbone en présence d’eau ou d’alcool et d’un catalyseur comme Ni(CO)4 en formant un acide 見-éthylénique ou son ester: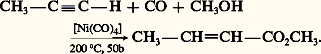 OligomérisationSous l’action du chlorure cuivreux, l’acétylène se dimérise en vinylacétylène; l’addition d’acide chlorhydrique à ce dernier conduit au 2-chlorobuta-1,3-diène, chloroprène qui est un monomère important de la chimie des élastomères:
OligomérisationSous l’action du chlorure cuivreux, l’acétylène se dimérise en vinylacétylène; l’addition d’acide chlorhydrique à ce dernier conduit au 2-chlorobuta-1,3-diène, chloroprène qui est un monomère important de la chimie des élastomères: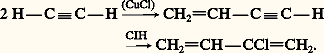 Les alcynes se cyclotrimérisent sous l’action de catalyseurs comme Co2(CO)8 en formant des mélanges d’hydrocarbures aromatiques (réactions 9).IsomérisationSous l’action de bases très fortes, comme NaNH2, la triple liaison d’un alcyne migre réversiblement en formant l’acétylénique vrai, stabilisé sous forme d’acétylure. Des bases moins fortes, comme NaOH, dont l’acide conjugué est plus fort que l’acétylénique, provoquent également cette isomérisation mais avec formation de l’acétylénique interne, de plus grande stabilité thermodynamique. Le réarrangement est une suite d’échanges acide-base, mettant en jeu le proton en 見 de la triple liaison et passant par un intermédiaire allénique:
Les alcynes se cyclotrimérisent sous l’action de catalyseurs comme Co2(CO)8 en formant des mélanges d’hydrocarbures aromatiques (réactions 9).IsomérisationSous l’action de bases très fortes, comme NaNH2, la triple liaison d’un alcyne migre réversiblement en formant l’acétylénique vrai, stabilisé sous forme d’acétylure. Des bases moins fortes, comme NaOH, dont l’acide conjugué est plus fort que l’acétylénique, provoquent également cette isomérisation mais avec formation de l’acétylénique interne, de plus grande stabilité thermodynamique. Le réarrangement est une suite d’échanges acide-base, mettant en jeu le proton en 見 de la triple liaison et passant par un intermédiaire allénique: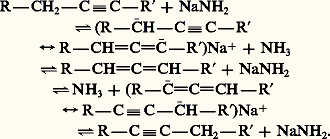 OxydationLe permanganate de potassium concentré et neutre coupe les alcynes, au niveau de la triple liaison, en deux acides carboxyliques. Dans le cas des alcynes vrais, l’acide formique se trouve plus ou moins oxydé en gaz carbonique. Cette coupure oxydante permet de fixer la position de la triple liaison dans la chaîne.Propriétés particulières des alcynes vraisCe sont des réactions qui concernent la substitution de l’hydrogène acétylénique et qui conservent la triple liaison.MétallationL’hydrogène fonctionnel des alcynes vrais présente une certaine acidité: le pK a correspondant est de 25. Moins acides que les alcools dont le pK a est de 16-19, ils le sont plus que l’ammoniac qui a un pK a de 38; ce qui permet de les métaller par réaction avec un amidure métallique:
OxydationLe permanganate de potassium concentré et neutre coupe les alcynes, au niveau de la triple liaison, en deux acides carboxyliques. Dans le cas des alcynes vrais, l’acide formique se trouve plus ou moins oxydé en gaz carbonique. Cette coupure oxydante permet de fixer la position de la triple liaison dans la chaîne.Propriétés particulières des alcynes vraisCe sont des réactions qui concernent la substitution de l’hydrogène acétylénique et qui conservent la triple liaison.MétallationL’hydrogène fonctionnel des alcynes vrais présente une certaine acidité: le pK a correspondant est de 25. Moins acides que les alcools dont le pK a est de 16-19, ils le sont plus que l’ammoniac qui a un pK a de 38; ce qui permet de les métaller par réaction avec un amidure métallique: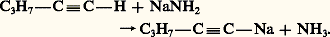 Une réaction analogue se produit avec les organomagnésiens et les organolithiens.
Une réaction analogue se produit avec les organomagnésiens et les organolithiens.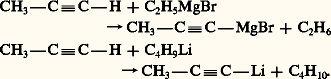 Les organométalliques ainsi obtenus se comportent en général comme les organométalliques saturés, d’où leur emploi à l’introduction du groupe acétylénique dans de nombreuses synthèses.Les métaux de transition, principalement le cuivre et l’argent, engendrent des dérivés métalliques. Cette substitution a déjà lieu pour le cuivre divisé, avec dégagement d’hydrogène; elle se fait plus facilement en présence de chlorure cuivreux solide, en suspension dans l’eau, mais elle n’est alors que superficielle. Elle devient quantitative en présence de chlorure cuivreux ammoniacal:
Les organométalliques ainsi obtenus se comportent en général comme les organométalliques saturés, d’où leur emploi à l’introduction du groupe acétylénique dans de nombreuses synthèses.Les métaux de transition, principalement le cuivre et l’argent, engendrent des dérivés métalliques. Cette substitution a déjà lieu pour le cuivre divisé, avec dégagement d’hydrogène; elle se fait plus facilement en présence de chlorure cuivreux solide, en suspension dans l’eau, mais elle n’est alors que superficielle. Elle devient quantitative en présence de chlorure cuivreux ammoniacal: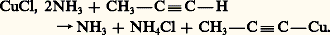 C’est une réaction très sensible, le précipité jaune formé permettant de déceler des quantités d’alcyne vrai très inférieures au milligramme.En solution alcoolique, le nitrate d’argent forme, avec les alcynes vrais, des cristaux peu solubles, ayant généralement la composition:
C’est une réaction très sensible, le précipité jaune formé permettant de déceler des quantités d’alcyne vrai très inférieures au milligramme.En solution alcoolique, le nitrate d’argent forme, avec les alcynes vrais, des cristaux peu solubles, ayant généralement la composition: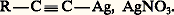 Le nitrate d’argent ammoniacal conduit à des précipités amorphes:
Le nitrate d’argent ammoniacal conduit à des précipités amorphes: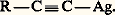 Les dérivés cuivreux et argentiques sont peu réactifs; les premiers termes sont explosifs. Ils sont hydrolysés par les acides forts en régénérant l’alcyne. Les halogènes les transforment en halogéno-acétyléniques. Toutefois, on connaît une réaction inattendue avec les bromo-acétyléniques:
Les dérivés cuivreux et argentiques sont peu réactifs; les premiers termes sont explosifs. Ils sont hydrolysés par les acides forts en régénérant l’alcyne. Les halogènes les transforment en halogéno-acétyléniques. Toutefois, on connaît une réaction inattendue avec les bromo-acétyléniques: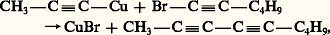 laquelle ne se produit pas si on remplace le brome par un autre halogène ou le cuivre par un autre métal.L’oxydation des dérivés cuivreux par l’air ou par l’acide ferricyanhydrique provoque une duplication:
laquelle ne se produit pas si on remplace le brome par un autre halogène ou le cuivre par un autre métal.L’oxydation des dérivés cuivreux par l’air ou par l’acide ferricyanhydrique provoque une duplication: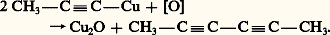 HalogénationL’hydrogène fonctionnel peut être remplacé par un halogène. Cette substitution se produit sous l’action des halogènes en milieu alcalin: l’alcyne est transformé en sa base conjuguée, alcynure, qui est fortement nucléophile et attaque la molécule d’halogène ou d’acide hypohalogéneux:
HalogénationL’hydrogène fonctionnel peut être remplacé par un halogène. Cette substitution se produit sous l’action des halogènes en milieu alcalin: l’alcyne est transformé en sa base conjuguée, alcynure, qui est fortement nucléophile et attaque la molécule d’halogène ou d’acide hypohalogéneux: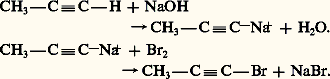 Ces halogéno-acétyléniques sont peu réactifs, ils forment avec le magnésium des organomagnésiens R 漣C 令C 漣MgX.AlcynylationCe sont les réactions de l’anion alcynure, fortement nucléophile, sur des substrats carbonés, soit en substitution, soit en addition.La substitution d’un halogénure d’alkyle conduit à une alkylation de l’alcyne, avec toutefois une réaction parallèle d’élimination due à la forte basicité de l’alcynure.L’addition des alcynes vrais, en milieu alcalin, aux dérivés carbonylés conduit, réversiblement, aux alcools 見-acétyléniques:
Ces halogéno-acétyléniques sont peu réactifs, ils forment avec le magnésium des organomagnésiens R 漣C 令C 漣MgX.AlcynylationCe sont les réactions de l’anion alcynure, fortement nucléophile, sur des substrats carbonés, soit en substitution, soit en addition.La substitution d’un halogénure d’alkyle conduit à une alkylation de l’alcyne, avec toutefois une réaction parallèle d’élimination due à la forte basicité de l’alcynure.L’addition des alcynes vrais, en milieu alcalin, aux dérivés carbonylés conduit, réversiblement, aux alcools 見-acétyléniques: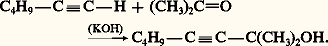 Cette réaction réalisée avec l’acétylène et le méthanal en solution aqueuse et en présence d’acétylure cuivreux est une préparation industrielle du butyne-1,4-diol:
Cette réaction réalisée avec l’acétylène et le méthanal en solution aqueuse et en présence d’acétylure cuivreux est une préparation industrielle du butyne-1,4-diol: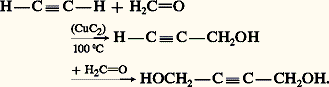
Encyclopédie Universelle. 2012.
